Semillas de Ciencias Jacinto Convit. Este Blog es de carácter informativo y Educativo dirigido a la comunidad estudiantil e interesados en aprender ciencias. Pretendemos informar y promover conocimientos para la promoción de la salud, como base fundamental de nuestra ETA Osmar Uridan Sánchez Paredes.
4 ago 2023
3 ago 2023
Elaboración de cloro comercial a base de sal común
2 ago 2023
Reconociendo nuestra labor Educativa
Reconocimiento recibido por la institución debido a su participación en el reto de ciencias naturales llamado "Elaboración de cloro comercial a partir de sal común" utilizando el método de la electrólisis de una disolución saturada de cloruro de sodio. Los estudiantes participantes fueron por sexto año de laboratorio clínico: Sutil Pedro y Castillo Marcelo. Por quinto año de laboratorio clínico: Plaza Wuilliam, González Adrianis y Wilchez Victoria. El profesor asesor fue Franklin Burguillos. Este trabajo fue ganador en las fases institucional, circuital, municipal y Estadal. Además participó en las Olimpiadas científicas nacionales de Ciencias Naturales y matemáticas, cerrando con la participación en el Festival de Ciencias y Tecnología de Miranda del año 2023.
Bienvenidos a nuestro Blog Educativo de la ETA Osmar Uridan Sánchez Paredes
Nuestro Blog "Semillas de Ciencias Jacinto Convit" de la ETA Osmar Uridan Sánchez Paredes, tiene la finalidad de informar sobre las actividades científicas realizadas en la institución . Pretendemos dar a conocer las aplicaciones de las ciencias naturales en los avances científicos en el área de promoción de la salud a nivel nacional y mundial.
24 nov 2019
OXISALES
OXISALES
Son compuestos ternarios caracterizados por poseer en su fórmula METAL+NO METAL+OXÍGENO. Se obtienen al sustituir el o los hidrógenos de un oxácido por un elemento metálico. Una de las reacciones características para su obtención es la ácido base:
OXÁCIDO + HIDRÓXIDO O BASE --> OXISAL + AGUA
HNO3 + NaOH --> NaNO3 + H2O
ácido nítrico + hidróxido de sodio --> nitrato de sodio + agua
Para nombrar las oxisales existen varias reglas:
1) Tradicional: El nombre del ácido se cambia de la siguiente forma: se quita la palabra ácido y la terminación del no metal se cambia de oso a ITO y ico a ATO, luego se coloca el nombre correspondiente del metal. Por ejemplo:
NaNO3 se llama NITRATO DE SODIO
CuSO4 se llama SULFATO CÚPRICO
2) Sistemática:
NaNO3 se llama TRIOXONITRATO(V) DE SODIO
CuSO4 se llama TETRAOXOSULFATO(VI) DE COBRE(II)
23 nov 2019
OXÁCIDOS
OXÁCIDOS
Son compuestos ternarios caracterizados por poseer en su fórmula HIDRÓGENO-NO METAL-OXÍGENO. Se obtienen al hacer reaccionar un ÓXIDO NO METÁLICO con AGUA.
óxido no metálico + agua --> oxácido
MxOy + H2O --> H2MxOy+2
donde M = no metal; O = oxígeno; x,y es la atomicidad del óxido no metálico.
Si x y y+2 son pares se debe simplificar la fórmula por 2. Por ejemplo:
H2N2O4 se simplifica a HNO2
Para nombrar oxácidos se utiliza varias formas:
1) Tradicional: Se coloca la palabra ÁCIDO seguida de la raíz del nombre del no metal con la terminación (oso-ico) correspondiente.
Por ejemplo: HNO2 ácido nitroso; HNO3 ácido nítrico; HClO ácido hipocloroso; HClO2 ácido cloroso; HClO3 ácido clórico; HClO4 ácido perclórico.
2) Sistemático: Se coloca el prefijo que indica la cantidad de oxígenos (mono, di, tri, tetra) seguida de OXO luego la raíz del nombre del no metal con terminación ATO (número de oxidación en romanos) seguido de la preposición DE y por último el prefijo que indica la cantidad de hidrógenos (mono-di-tri-tetra) seguido de la palabra HIDRÓGENO. Por ejemplo: HNO2 Dioxo nitrato(II) de hidrógeno. HClO4 tetraoxo clorato(VII) de hidrógeno.
3) se coloca la palabra ÁCIDO, luego el prefijo que indica la cantidad de oxígenos (mono-di-tri-tetra) seguida de OXO luego la raíz del nombre del no metal con terminación ICO (número de oxidación en romano). Por ejemplo: HNO2 ácido dioxo nítrico(II); HClO4 ácido tetraoxo clórico(VII)
17 nov 2019
HIDROCARBUROS INSATURADOS
HIDROCARBUROS INSATURADOS
Los hidrocarburos saturados (alcanos) se caracterizan por poseer enlace covalente simple entre carbonos, a su vez, los hidrocarburos insaturados (alquenos y alquinos) se caracterizan por poseer enlaces covalente doble y triple entre carbonos respectivamente.
Para transformar un enlace covalente simple entre dos carbonos en los alcanos en un enlace doble, cada carbono del alcano debe perder un átomo de hidrógeno, formándose un nuevo enlace entre los carbonos involucrados "enlace covalente doble". Para transformar un enlace covalente simple de un alcano entre dos carbonos en enlace covalente triple, cada carbono debe perder dos hidrógenos. Por ello, las fórmulas generales de cada tipo de hidrocarburo difiere en dos hidrógenos al pasar de una a otra:
HIDROCARBURO FÓRMULA GENERAL
Alcano CnH2n+2
Alqueno CnH2n
Alquino CnH2n-2
Donde n es la cantidad de carbonos que posee el hidrocarburo.
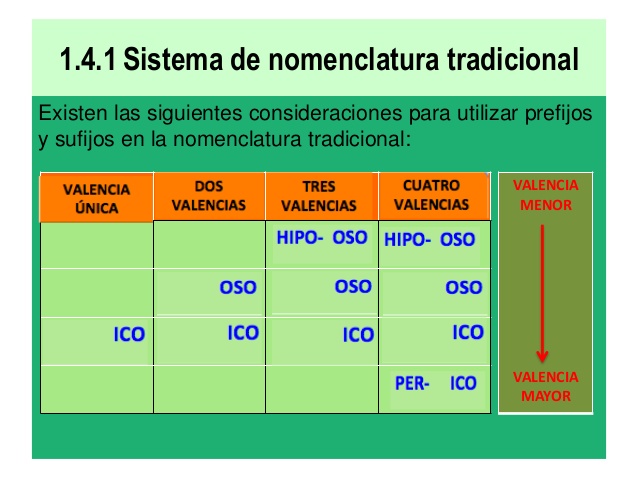
NOMENCLATURA TRADICIONAL SU RAZÓN DE EXISTENCIA
NOMENCLATURA TRADICIONAL
BREVE EXPLICACIÓN DE SU USO EN LA QUÍMICA INORGÁNICA
La nomenclatura tradicional o antigua cuando fue creada por los químicos en su momento permitió nombrar los compuestos químicos inorgánicos de una manera sistemática y exacta para que todos los estudiantes y científicos pudieran nombrar compuestos, esas reglas las podemos simplificar de la siguiente forma:
1) Si un elemento posee un único número de oxidación o valencia, se debe nombrar colocando la terminación ICO a la raíz de su nombre. Por ejemplo:
Sodio = sódico; potasio = potásico; magnesio = magnésico; aluminio = alumínico, entre otros.
Cabe destacar que también se puede usar su nombre, por ello se colocan ambos casos.
Por ejemplo, para nombrar un óxido básico tenemos:
MgO se puede llamar como óxido magnésico u óxido de magnesio indistintamente ya que el magnesio posee valencia 2 única.
2) Si el elemento posee dos valencias o números de oxidación positivos se debe usar la raíz del nombre del elemento en latín o griego con terminación OSO para la valencia menor y la terminación ICO para la mayor. Por ejemplo:
Hierro (español) = Ferrum(latín) = Ferr (raíz en latín). Se debe llamar FERROSO cuando su valencia es 2 y FERRICO cuando su valencia es 3.
3) Si el elemento posee tres valencias o números de oxidación positivas, se debe utilizar la raíz de su nombre en latín o griego colocando HIPO-RAIZ-OSO a la menor valencia, RAIZ-OSO a la intermedia e RAIZ-ICO a la mayor respectivamente. Por ejemplo:
Cromo (español) = Hipocromoso (menor valencia); Cromoso (valencia intermedia) y Crómico (mayor valencia)
4) Si el elemento posee cuatro valencias o números de oxidación se debe usar HIPO-RAIZ-OSO (menor valencia); RAIZ-OSO (segunda valencia); RAIZ-ICO (tercera valencia); PER-RAIZ-ICO (mayor valencia). Por ejemplo:
Cloro (español) = Hipocloroso (menor valencia(+1)); cloroso (segunda valencia menor(+3)), clórico(tercera valencia mayor(+5)); perclórico (mayor valencia(+7)).
15 nov 2019
HIDRÓXIDOS O BASES INORGÁNICOS
HIDRÓXIDOS O BASES
Son compuestos ternarios inorgánicos constituidos por un elemento metálico unido al anión hidróxido u oxidrilo (OH) de carga elećtrica -1. Es decir; M(OH)n donde M es el símbolo del elemento metálico y n el número de oxidación de dicho elemento. Para obtenerlos debe reaccionar un óxido metálico con agua; por ejemplo: BaO + H2O --> Ba(OH)2. Para nombrarlos se utilizan las nomenclaturas conocidas:
a) Nomenclatura tradicional.
Caso 1: Cuando el metal posee un único número de oxidación;
1) NaOH hidróxido de sodio u hidróxido sódico
2) KOH hidróxido de potasio u hidróxido potásico
3) Mg(OH)2 hidróxido de magnesio u hidróxido magnésico.
4) Al(OH)3 hidróxido de aluminio u hidróxido alumínico
5) Ba(OH)2 hidróxido de bario u hidróxido bárico
Caso 2. Cuando el metal posee más de un número de oxidación;
1) Fe(OH)2 hidróxido ferroso
2) Fe(OH)3 hidróxido férrico
3) Pb(OH)2 hidróxido plumboso
4) Pb(OH)4 hidróxido plúmbico
5) Cr(OH)2 hidróxido hipocromoso
b) Nomenclatura sistemática (usar prefijos griegos que indican la atomicidad del compuesto; di-tri-tetra-penta-hexa-hepta-octa)
1) Fe(OH)3 trihidróxido de hierro
2) Fe(OH)4 tetrahidróxido de hierro
3) Pb(OH)2 dihidróxido de plomo
4) Pb(OH)4 tetrahidróxido de plomo
5) Cr(OH)2 dihidróxido de cromo
c) Nomenclatura Stock (usar números romanos para indicar el número de oxidación del metal; I-II-III-Iv-v-vI-vII-vIII)
1) Fe(OH)2 hidróxido de hierro(ii)
2) Fe(OH)3 hidróxido de hierro(iii)
3) Pb(OH)2 hidróxido de plomo(ii)
4) Pb(OH)4 hidróxido de plomo(iv)
5) Cr(OH)2 hidróxido de cromo(ii)
Suscribirse a:
Entradas (Atom)
Nuestra imagen: Jacinto Convit
El médico y científico venezolano Jacinto Convit, varias veces nominado al premio Nobel de Medicina por haber ideado una vacuna contra la le...

-
El método de la lluvia permite distribuir los electrones de cualquier átomo o ion en sus respectivos niveles y subniveles de energía. Lo...
-
En el siguiente link " Diferencias entre hidrácidos y oxácidos " encontrarás una breve explicación de las diferencias básicas ent...